Distribuo de elektronoj
La atomoj konsistas el kerno de protonoj kaj neŭtronoj kaj la elektronoj kiuj distribuiĝas ĉirkau la kerno. Neŭtrala atomo havas sammulte da elektronoj kaj protonoj.
La orbitaloj
La elektronoj distribuiĝas laŭ sia energinivelo en orbitalojn. Ĉiu orbitalo povas esti identigita per tri nombroj n, l kaj m kun la sekvaj ecoj:
precipa kvantumnombro n
Ĝi indikas la ŝelon kaj estas natura nombro 1, 2, 3 ktp. (Foje oni indikas ĝin ankaŭ per majusklo: K, L, M ktp.)
kroma kvantumnombro l
Ĝi indikas la subŝelon (aŭ angulan movokvanton) kaj varias inter 0 kaj n - 1. La energinivelo de subŝelo kreskas laŭ la sumo n + l. Anstataŭ numeroj oni uzas minusklojn por nomi la subŝelon: s, p, d, f.
magneta kvantumnombro m
Ĝi varias inter -l kaj l kaj donas la orbitalon ene de subŝelo.
spina kvantumnombro s
Ĉiu orbitalo povas enhavi maksimume du elektronojn. Ili devas havi distingan spinon -1/2 aŭ +1/2, respektive supren aŭ malsupren.
Ĉar elektronoj estas fermionoj, ili obeas al la ekskluda principo de Pauli, do du en sama loko ne povas havi saman kvantuman staton kaj tiel klariĝas la distribuo de elektronoj en la orbitaloj de atomo. Kaj el tio estiĝas la konstruo de la perioda sistemo de elementoj (vidu pli malsupre).
ondofunkcioj de orbitaloj
Kie en la atomo troviĝas do la orbitaloj kun la elektronoj? Pli malpli “ĉie kaj nenie”. La kvar supraj nombroj estas parametroj de ondofunkcioj, kiuj priskribas la elektronojn kaj donas al ĉiu loko varian probablecon, ke elektrono troviĝas tie. La ŝelo kaj subŝelo priskribas energinivelojn. Ju pli alta ĝi estas, des pli rapide averaĝe moviĝas elektrono kaj des pli verŝajne ĝi troviĝas distance de la nukleo, t.e. la centro de la atomo.
orbitaloj de hidrogenatomo
Elektu valoron por n/l kaj m malsupre!
(En la supra diagramo la surfacoj prezentas la spacon ene de kiu troviĝas elektrono de tiu orbitalo kun 95%-a probableco. En la blua areo la ondfunkcio estas pozitiva en la ruĝa negativa. La surfaco foje aperas iom anguleca pro limigo de la prezentoalgoritmo.)
Oni povas uzi analogion de tambura membrano por tiuj ĉi ondofunkcioj. En tiu analogio la averaĝa distanco de la ripoza stato respondas al la verŝajneco, ke elektrono troviĝas en tiu pozicio de la centro. La ventroj de staranta ondo membrana do respondas al la eksteraj formoj de la orbitaloj. 1
 n=1, l=s
n=1, l=s
|
|
 n=2, l=s
n=2, l=s
|
 n=2, l=p
n=2, l=p
|
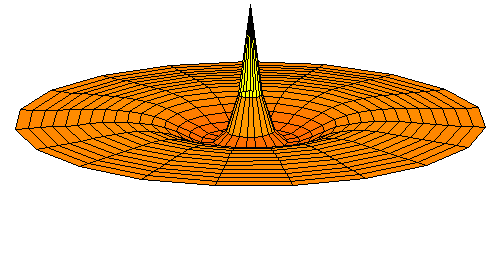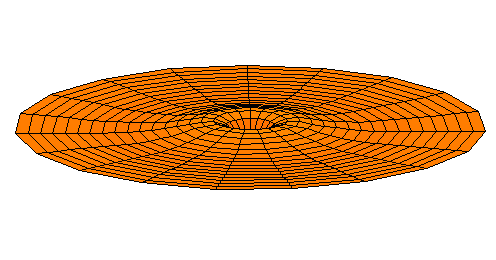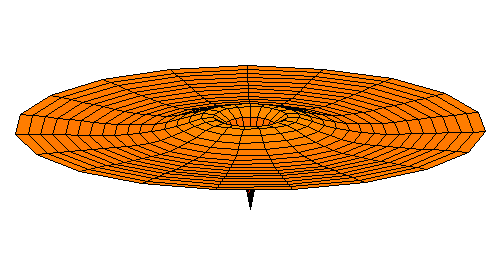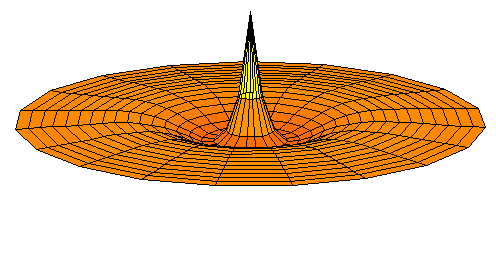 n=3, l=s
n=3, l=s
|
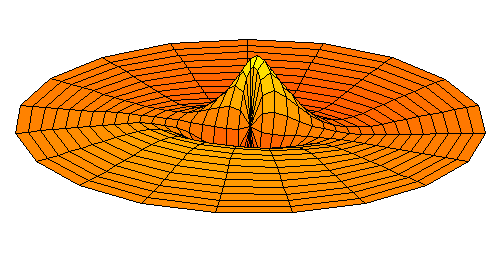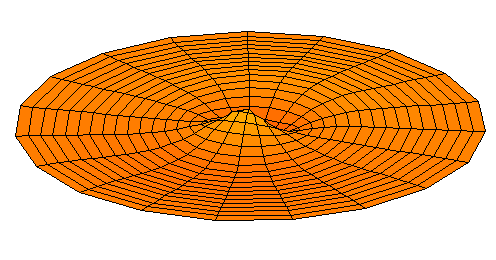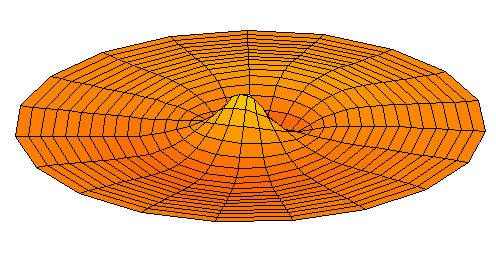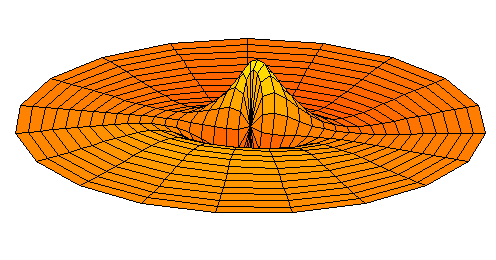 n=3, l=p
n=3, l=p
|
La membrano havas nur du dimensiojn (ĉar la tria donas la probablecon). Ĉe la atomoj aldoniĝas tria dimensio de spaco. Sed la tranĉbildoj de orbitalfunkcioj efektive tre similas al la ondbildoj de tambura membrano.
Do oni povus imagi izolitan atomon kiel globforman tamburan membranon, fiksitan en la centro, kie troviĝas la nukleo kaj kiu ne ĉesas soni. Koncedite, tio estas malfacile, sed eble pli bone ol neniu analogio.
Notado laŭ Paŭling
8 - oksigeno (O)
La notmaniero laŭ Pauling montras la distribuon de la elektronoj en la orbitalojn. La subŝeloj en tiu prezento estas aranĝitaj tiel, ke la supraj havas pli altan energinivelon ol la malsupraj.
La konstruo de atomoj kaj aparte la distribuo de la elektronoj influas la ĥemiajn ecojn de la elementoj kaj per tiuj ecoj oni enordigas ilin en la periodan sistemon de elementoj.